Още по темата
Бизнес и Пазари
Когато финансовата информация се превърне във възможност за бъдещи анализатори.
Развитието на лекарствените продукти, медицинските и регулаторни дейности се извършват в следните отдели:
Под ръководството на Регулаторни въпроси и с участието на други дирекции, документацията за регистрация на лекарствен продукт се изготвя в съответствие с действащите нормативни изисквания в страната, досиетата в електронен формат (eCTD) са подготвени за регистрация на нови лекарства чрез централизирани и национални процедури, за подновяване на издадени разрешения за търговия, както и промени в документацията.
Целта е да регистрираме нови продукти, които да добавят стойност към портфолиото на "Софарма", най-бързо и рентабилно. Ето защо нашата регулаторна стратегия за регистрация на нови продукти чрез децентрализирана процедура е приоритет. Положителната оценка на нашите досиетата от 14 европейски национални компетентни органи показва, че ние разработваме качествени, безопасни и ефикасни лекарствени продукти и документацията или отговаря на действащите регулаторни изисквания.
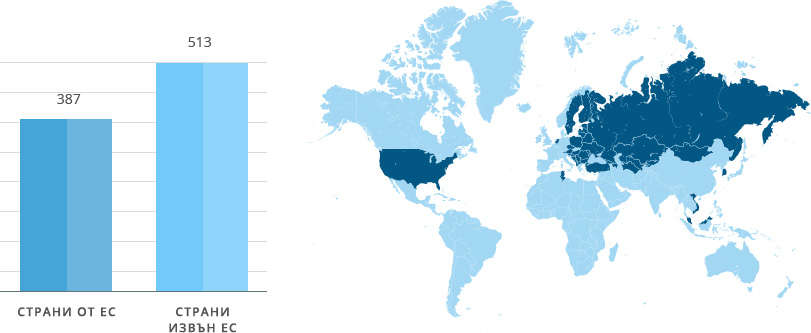
"Софарма" АД притежава 900 разрешения за употреба по целия свят.